快来看!!!二次配方注册最新政策来了
-
2021-06-17 08:50 来源于:奶粉圈
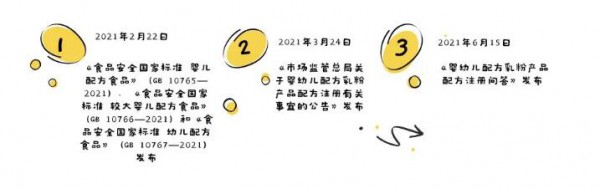
昨日,为进一步指导企业科学开展婴配粉配方研发及试生产工作、规范注册材料申报,国家市场监督管理总局发布关于《婴幼儿配方乳粉产品配方注册问答》。
随着各政策的陆续发布,关于二次配方注册的事宜越发明了,大家关于二次配方注册的疑惑也逐步得到解决,今天奶粉圈就《婴幼儿配方乳粉产品配方注册问答》,给大家梳理一下二次配方注册的关键点。
1、新国标or老国标?
自新国标发布之日(2021年2月22日)起,申请人即可按新国标提出产品配方注册(含变更、延续)申请,获得注册后可按新国标组织生产。也可按《食品安全国家标准 婴儿配方食品》(GB 10765-2010)和《食品安全国家标准 较大婴儿和幼儿配方食品》(GB 10767-2010)提出产品配方注册(含变更、延续)申请,但至新国标实施之日(2023年2月22日)起,生产企业应当按新国标注册的产品配方组织生产,建议申请人综合考虑注册申请受理、审评审批工作时限。
2、变更or注更?
①变更:对已获注册的产品配方,申请人按新国标调整配方的,原则上按变更注册办理,如0-6月龄(1 段)增加胆碱,6-12月龄(2段)增加胆碱、硒、锰,维生素、矿物质的化合物来源和食品添加剂制剂有效成分含量调整等情形。
②注更:已获注册的产品配方增加或去除可选择成分的,按注销原配方申请新配方注册办理。其中,涉及膳食纤维(包括低聚果糖、低聚半乳糖、多聚果糖、棉子糖、聚葡萄糖、酵母β-葡聚糖等)、核苷酸以及可用于婴幼儿食品的菌种等三类原料的,仅当添加或去除某一类原料时,按注销原配方申请新配方注册办理,同一类别内原料品种调整不需注更。
3、需提供哪些申请材料?
已获注册的产品配方按新国标申请注册(含变更)的,需提交以下材料,未发生变化的材料不再重复提交,如原料和食品添加剂执行标准未发生变化的可不再重复提交(食品添加剂制剂除外);注册证书载明工艺未发生变化的,生产工艺说明可不再重复提交;污染物、微生物、真菌毒素等可能含有的危害物质的控制方案未发生变化的可不再重复提交。
(一)婴幼儿配方乳粉产品配方注册申请书(或变更注册申请书);
(二)配方调整的相关研发论证材料;
配方调整的相关研发论证材料包括以下内容:
①列表对比与已注册配方的调整内容(如原料和食品添加剂标准、配方组成及用量表、营养成分表等),并对调整的情况及理由进行说明;
②食品添加剂制剂需提供组成成分及其使用量,以及组成成分的执行标准;
③不少于三批次商业化生产工艺验证报告,包括三批次试生产的原辅料投料信息,以及对样品均匀性、工艺稳定性及营养成分符合性的分析。
原辅料投料信息包括试生产时各原辅料的投料量、原辅料批号、试生产日期、 试生产样品批号及理论产量、实际产量、物料平衡核算等。干湿法复合工艺应验证从湿法工艺投料开始,至成品包装结束的三批次完整的工艺过程。
样品均匀性分析指同一批次内样品均匀性分析,例如在不同时段至少取3个以上的试生产成品样品,对样品中不易混匀的指标等进行检测及变异系数分析,提供均匀性判定标准,并分析说明样品均匀性。样品均匀性分析指标至少包括必需成分中的宏量营养素、维生素、矿物质,可选择成分及其他不易混匀的成分。每类指标中应选择添加量较小的、不易混匀的成分(如活性菌、乳铁蛋白)。
工艺稳定性分析包括:不同批次间的稳定性分析,例如对三批次试生产样品中不稳定的指标等进行检测及变异系数分析,提供稳定性判定标准,并分析说明工艺稳定性;主要生产工序工艺参数的稳定性分析,如对主要工序的参数进行多批次测定,判断生产工艺参数是否在要求范围内,从而确定设备工艺的稳定性。
营养成分符合性分析包括至少分析一批次试生产样品的营养成分是否符合标准及标签值的要求。
④配方明显差异性说明;
明显差异是指营养特性而非营养成分品种,产品配方及其差异性的基础应为母乳研究、营养学研究成果。添加的膳食纤维品种和(或)量不同、添加的核苷酸品种
(或)量不同、添加的活性菌品种和(或)量不同均不属于同一申请人同年龄段配方之间有明显差异。
⑤污染物、微生物、真菌毒素等可能含有的危害物质的控制方案;
⑥添加活性菌种的配方,还需提交菌株溯源、杂菌污染防控等相关材料。
菌株溯源、杂菌污染防控等相关材料包括菌株原料的来源说明、菌株鉴定报告以及因使用菌株可能引起产品杂菌污染的防控措施(如活性菌原料的质量规格和检测报告、活性菌原料管理、成品生产相关过程控制、成品中相关项目检测等措施)
(三)产品配方;
(四)生产工艺说明(注册证书载明工艺发生变化时需提交);
生产工艺说明包括以下材料:
①注册证书载明工艺变化的理由及合理性。
②同一系列不同配方之间生产工艺(包括生产工序、工艺参数、关键控制点、主要生产设备、作业区划分、原辅料添加环节等)的异同说明,并列表标注主要区别。
湿法工艺的主要生产工序一般包括净乳及巴氏杀菌(使用生乳)、配料、均质、杀菌、浓缩、喷雾干燥与冷却降温、产品包装;干法工艺一般包括备料进料、计量配料、预混、干混、产品包装;干湿法复合工艺包括上述湿法工艺和干法工艺的全部主要生产工序。
③完整的生产工艺流程图及其文本。生产工艺流程图应文字清晰,标明主要生产工序、关键控制点及其工艺参数、作业区划分情况。生产工艺文本包括生产工艺文本说明、相关生产设备(名称、型号)、关键控制点控制参数和控制措施。
生产工艺文本说明指与生产工艺流程图相对应的文字说明,包括流程图中标注的各工序说明、工艺参数,以及各原辅料的添加环节、添加顺序、添加方式。
相关生产设备以主要生产设备一览表形式提供,包括设备名称和型号。湿法工艺设备包括:巴氏杀菌设备(使用生乳)、配料设备、均质设备、杀菌设备、浓缩设备、喷雾干燥设备、包装设备;干法工艺设备包括:隧道杀菌设备、计量配料设备、预混设备、混合设备、产品包装设备;干湿法复合工艺设备包括上述湿法生产和干法生产的设备。
关键控制点控制参数和控制措施可根据企业实际需要确定,包括关键控制点设置的科学性、合理性说明,以及控制参数和控制措施的详细描述。
(五)产品检验报告;
(六)产品稳定性研究材料;
已获注册的产品配方按新国标调整的,无论按变更注册、还是新配方注册,均需提供货架期稳定性研究材料。申请人可以提交加速试验研究材料,也可以提交长期试验材料。用于稳定性研究的样品应是商业化生产条件下生产,原则上与生产工艺验证所用样品同批次,如使用不同批次应说明理由。
产品货架期稳定性研究时,对于无国标检测方法采用自建检测方法的,可参照《合格评定 化学分析方法确认和验证》(GB/T 27417-2017)进行验证,提交验证材料。
申请人应具备配方的研发能力,产品货架期稳定性研究需自行完成。稳定性研究中的试验项目可根据实际情况自行和(或)委托第三方检测机构进行检测,委托第三方检测机构的需说明理由。第三方检测机构需具备检测项目的资质,对检测结果负责。
如果按新国标调整前后的配方添加的活性菌相同,且水分活度无明显差异时,可以使用调整前同一申请人已获注册配方的历史长期数据进行分析。
(七)标签样稿。
在竞争越发激烈的当下,谁能率先通过新国标的二次注册,谁就能抢占先机,大家一定要加快二次配方注册的申请。奶粉圈也将持续关注二次配方注册的相关政策和消息,为大家带来解读。
-
婴幼儿食品行业快讯:伊利股权激励方案获股东大会通过........
09-30
-
内容涉及乳业!国家发改委、农业农村部等五部门联合发文促进消费
乳业 07-02
-
奥运TOP伙伴蒙牛“要强”闪耀奥预赛 成为每个人运动的合作伙伴
奥运,蒙牛 05-30
-
“致癌卫生巾黑名单”旧闻重提,多家卫生巾品牌客服回应
产后卫生巾,孕妇卫生巾 05-19
-
这些乳企,拟被认定为农业产业化国家重点龙头企业
乳企 05-14
- 搜产品
- 搜品牌
- 搜企业
- 行业 食品 服饰 寝居 用品 童车 孕妇 玩具 洗护 学习
-
大类
- 地区 北京 上海 重庆 天津 广东 河北 山西 辽宁 吉林